Immobiliséiert CALB
CALB gëtt immobiliséiert duerch kierperlech Adsorptioun op dem héich hydrophobesche Harz deen e makroporösen, Styren / Methacrylat-Polymer ass.Immobiliséierte CALB ass gëeegent fir Uwendungen an organeschen Léisungsmëttelen a Léisungsmëttel-gratis Systemer, a ka fir vill Mol an gëeegent Konditiounen recycléiert a weiderbenotzt ginn.
Produit Code: SZ-CALB- IMMO100A, SZ-CALB- IMMO100B.
★ Méi héich Aktivitéit, méi héich chiral Selektivitéit a méi héich Stabilitéit.
★ Besser Leeschtung an den net-wässerleche Phasen.
★ Einfach aus dem Reaktiounssystem ewechhuelen, séier Reaktiounen ofschléissen, a Proteinreschter am Produkt vermeiden.
★Kann recycléiert a weiderbenotzt ginn fir d'Käschte ze reduzéieren.
| Aktivitéit | ≥10000 PLU/g |
| pH Beräich fir Reaktioun | 5-9 |
| Temperaturbereich fir Reaktioun | 10-60 ℃ |
| Ausgesinn | CALB-IMMO100-A: Liicht giel bis brong fest CALB-IMMO100-B: Wäiss bis hellbrong fest |
| Partikelgréisst | 300-500 μm |
| Verloscht beim Trocknen bei 105 ℃ | 0,5%-3,0% |
| Harz fir Immobiliséierung | Makroporéis, Styren / Methacrylat Polymer |
| Reaktioun Léisungsmëttelbad | Waasser, organesch Léisungsmëttel, etc., oder ouni Léisungsmëttel.Fir d'Reaktioun an e puer organesche Léisungsmëttelen, kann 3% Waasser dobäi ginn fir de Reaktiounseffekt ze verbesseren |
| Partikelgréisst | CALB-IMMO100-A: 200-800 μm CALB-IMMO100-B: 400-1200 μm |
Eenheetsdefinitioun: 1 Eenheet entsprécht der Synthese vun 1μmol pro Minutt Propyllaurat aus Laurinsäure an 1-Propanol bei 60 ℃.Déi uewe genannte CALB-IMMP100-A an CALB-IMMO100-B entspriechen immobiliséierte Träger mat verschiddene Partikelgréissten.
1. Reaktertyp
Den immobiliséierten Enzym ass applicabel fir béid Kettel-Batch-Reaktor a Fixed Bett kontinuéierlech Flowreaktor.Et sollt bemierkt ginn datt d'Kräizung wéinst externer Kraaft während der Fütterung oder der Füllung vermeiden.
2. Reaktioun pH, Temperatur an Léisungsmëttelbad
Den immobiliséierten Enzym soll d'lescht addéieren, nodeems aner Materialien bäigefüügt an opgeléist ginn, an de pH ugepasst ginn.
Wann de Konsum vum Substrat oder d'Bildung vum Produkt zu der Verännerung vum pH während der Reaktioun féiert, sollt genuch Puffer zum Reaktiounssystem bäigefüügt ginn, oder de pH soll während der Reaktioun iwwerwaacht a ugepasst ginn.
Am Temperaturtoleranzberäich vu CALB (ënner 60 ℃) erhéicht d'Konversiounsquote mat der Erhéijung vun der Temperatur.Am praktesche Gebrauch soll d'Reaktiounstemperatur no der Stabilitéit vum Substrat oder Produkt ausgewielt ginn.
Allgemeng ass d'Esterhydrolysereaktioun gëeegent am Waasserfasesystem, während d'Estersynthesereaktioun am organesche Phasesystem gëeegent ass.Den organesche Léisungsmëttel kann Ethanol, Tetrahydrofuran, n-Hexan, n-Heptan an Toluen sinn, oder e passende gemëschte Léisungsmëttel.Fir d'Reaktioun an e puer organesche Léisungsmëttelen, kann 3% Waasser dobäi ginn fir de Reaktiounseffekt ze verbesseren.
3. Weiderbenotzen an Service Liewen vun CALB
Ënnert dem passenden Reaktiounsbedéngung kann CALB erëmfonnt a weiderbenotzt ginn, an déi spezifesch Uwendungszäiten variéiere mat verschiddene Projeten.
Wann de recuperéierten CALB net kontinuéierlech benotzt gëtt a muss no der Erhuelung gespäichert ginn, muss et gewäsch ginn a gedréchent a versiegelt bei 2-8 ℃.
No e puer Ronne vu Wiederverwendung, wann d'Reaktiounseffizienz liicht reduzéiert gëtt, kann CALB passend bäigefüügt ginn a weider benotzt ginn.Wann d'Reaktiounseffizienz eescht reduzéiert gëtt, muss se ersat ginn.
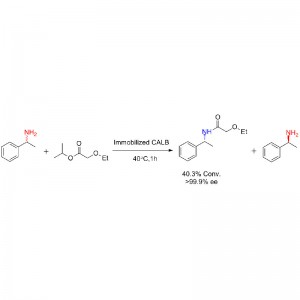
Beispill 1 (Aminolyse)(1):
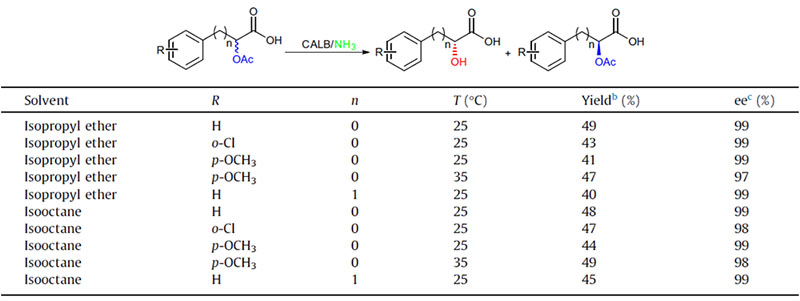
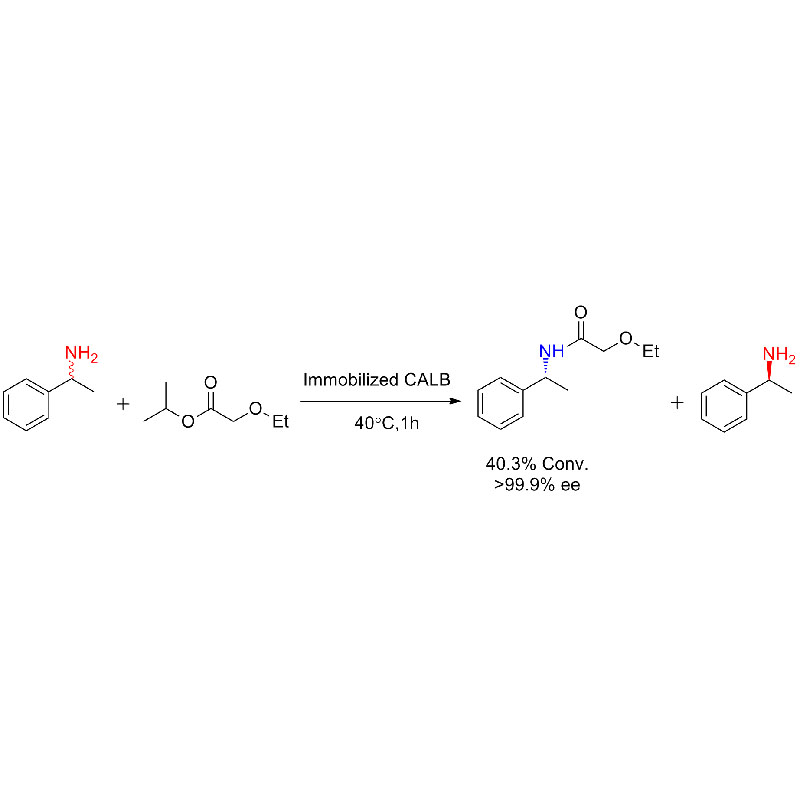
Beispill 2 (Aminolyse)(2):
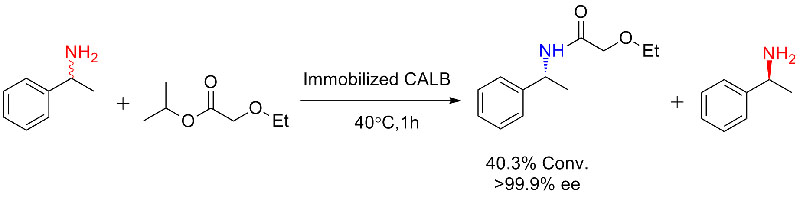
Beispill 3 (Ringöffnungspolyester Synthese)(3):
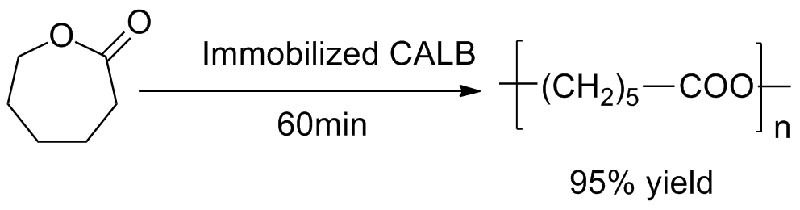
Beispill 4 (Transesterifikatioun, regioselektiv vun der Hydroxylgrupp)(4):
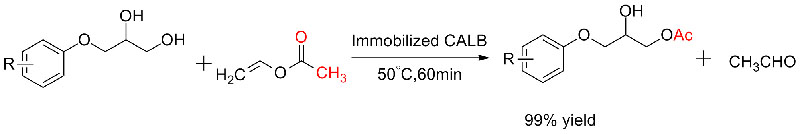
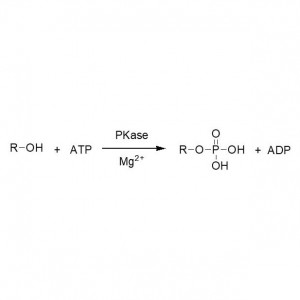
Beispill 5 (Transesterifikatioun, kinetesch Resolutioun vu racemeschen Alkoholen)(5):
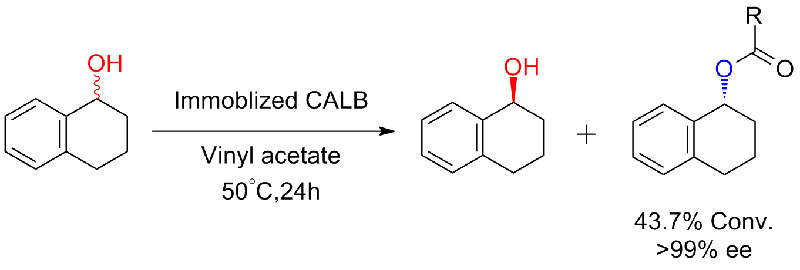
Beispill 6 (Esterifikatioun, kinetesch Resolutioun vu Carboxylsäure)(6):
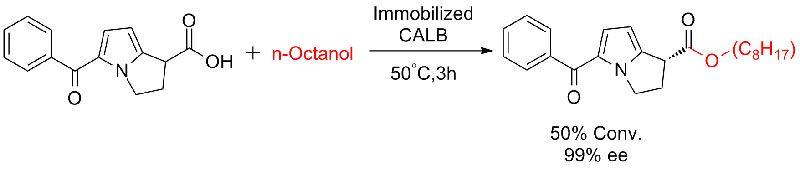
Beispill 7 (Esterolyse, kinetesch Resolutioun)(7):
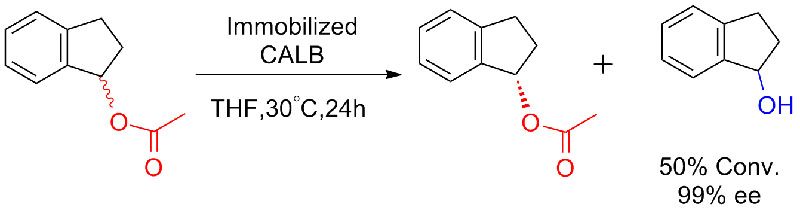
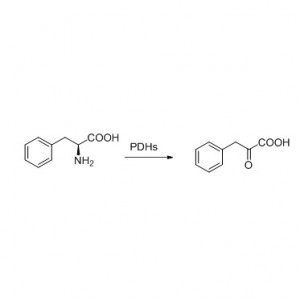
Beispill 8 (Hydrolyse vun Amiden)(8):
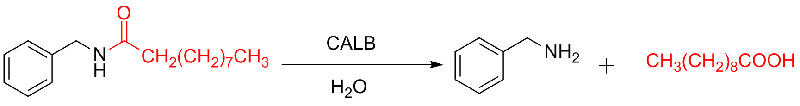
Beispill 9 (Acylatioun vun Aminen)(9):
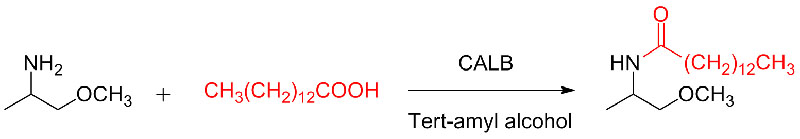

Beispill 10 (Aza-Michael Additioun Reaktioun)(10):
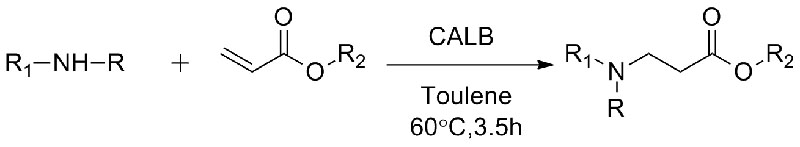
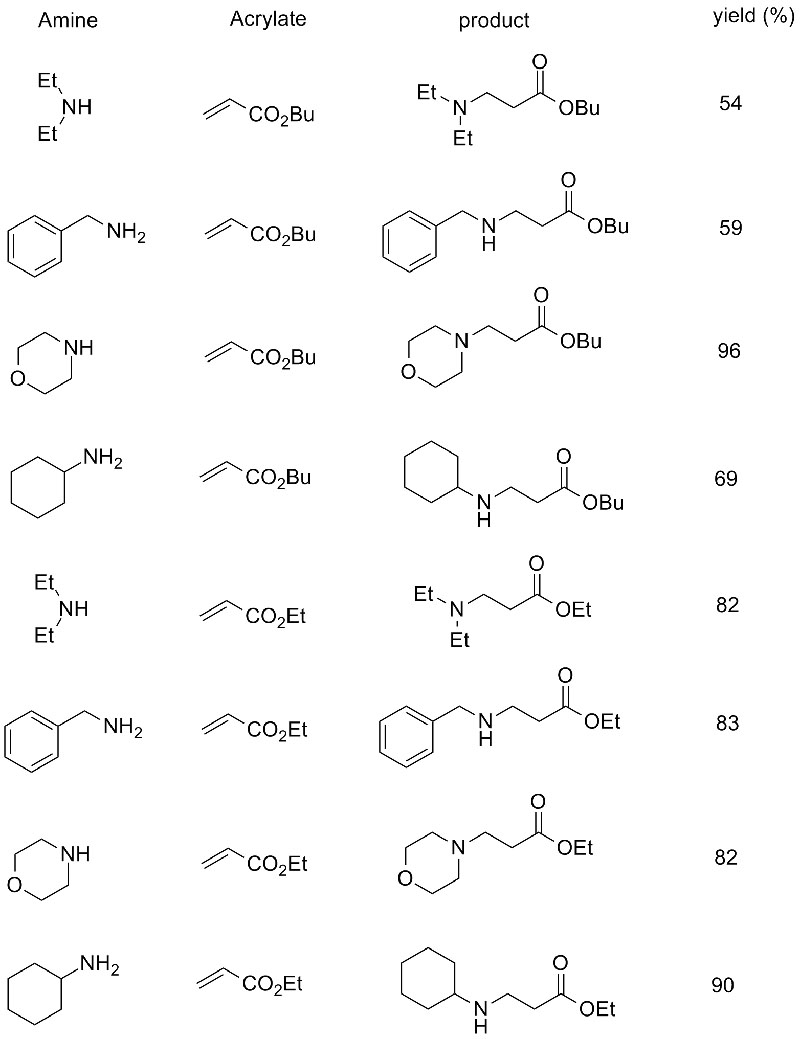
1. Chen S, Liu F, Zhang K, et al.Tetrahedron Lett, 2016, 57: 5312-5314.
2. Olah M, Boros Z, anszky GH, et al.Tetrahedron, 2016, 72: 7249-7255.
3. Nakaoki1 T, Mei Y, Miller LM, et al.Ind Biotechnol, 2005, 1(2):126-134.
4. Pawar SV, Yadav G DJ Ind. Eng.Chem, 2015, 31: 335-342.
5. Kamble MP, Shinde SD, Yadav G DJ Mol.Catal.B: Enzym, 2016, 132: 61-66.
6. Shinde SD, Yadav G D. Prozess Biochem, 2015, 50: 230-236.
7. Souza TC, Fonseca TS, Costa JA, et al.J. Mol.Catal.B: Enzym, 2016, 130: 58-69.
8. Gavil'an AT, Castillo E, L'opez-Mungu'AJ Mol.Catal.B: Enzym, 2006, 41: 136-140.
9. Joubioux FL, Henda YB, Bridiau N, et al.J. Mol.Catal.B: Enzym, 2013, 85-86: 193-199.
10. Dhake KP, Tambade PJ, Singhal RS, et al.Tetrahedron Lett, 2010, 51: 4455-4458.