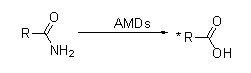
Amidase (AMD)
Enzymen:Sinn makromolekulär biologesch Katalysatoren, déi meescht Enzyme si Proteinen
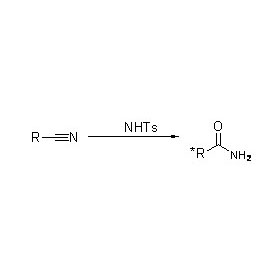
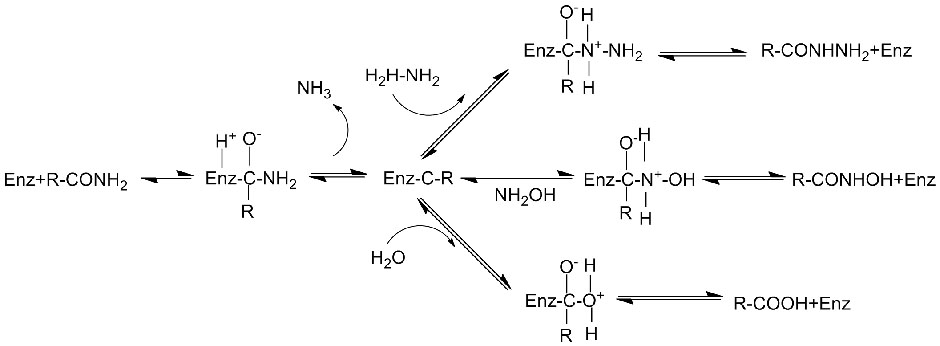
Amidase:Katalyséiert d'Hydrolyse vu verschiddenen endogenen an auslänneschen alifateschen an aromatesche Amiden andeems eng Acylgrupp op Waasser mat der Produktioun vu fräie Säuren an Ammoniak transferéiert gëtt.Hydroxamsäuren an aner organesch Säure gi wäit als Medikamenter benotzt well se Bestanddeeler vu Wuesstumsfaktoren, Antibiotike an Tumorinhibitoren sinn.D'Amidasen kënnen a R Typ a S Typ Acylasen opgedeelt ginn no der Katalysator Stereoselektivitéit.
Zousätzlech fir d'Hydrolyse vun Amiden ze katalyséieren, kann Amidase och Acyltransferreaktiounen an der Präsenz vu Co-Substrate wéi Hydroxylamin katalyséieren.
Amidase mat verschiddene Quellen hunn ënnerschiddlech Substratspezifizitéit, e puer vun hinnen kënnen nëmmen aromatesch Amiden hydrolyséieren, e puer vun hinnen kënnen nëmmen aliphatesch Amiden hydrolyséieren, an e puer α-oder ω-Aminoamiden hydrolyséieren.Déi meescht vun den Aminen hunn eng gutt katalytesch Aktivitéit nëmme fir azyklesch oder einfach aromatesch Amiden, awer fir komplex Aromaten, heterozyklesch Amiden, besonnesch Amiden mat ortho-Substituenten, sinn allgemeng niddereg an Aktivitéit (nëmmen e puer Enzyme weisen besser katalytesch Effekter).
Katalytesch Mechanismus:
| Enzymen | Produit Code | Produit Code |
| Enzympulver | ES-AMD-101~ ES-AMD-119 | e Set vun 19 Amidasen, 50 mg all 19 Elementer * 50mg / Stéck, oder aner Quantitéit |
| Screening Kit (SynKit) | ES-AMD-1900 | e Set vun 19 Amidasen, 1 mg all 19 Elementer * 1mg / Stéck |
★ Héich Substrat Spezifizitéit.
★ Staark chiral Selektivitéit.
★ Héich Konversioun Effizienz.
★ Manner Nebenprodukter.
★ Mëll Reaktioun Konditiounen.
★ ëmweltfrëndlech.
➢ Enzymscreening soll fir spezifesch Substrater duerchgefouert ginn wéinst der Substratspezifizitéit, an en Enzym kréien deen den Zilsubstrat mat beschte katalytesche Effekt katalyséiert.
➢ Kontaktéiert ni mat extremen Konditiounen wéi: héich Temperatur, héich/niddereg pH an organesch Léisungsmëttel mat héijer Konzentratioun.
➢ Normalerweis soll de Reaktiounssystem Substrat, Pufferléisung enthalen (Den optimalen Reaktioun pH vum Enzym).Co-Substrate wéi Hydroxylamin solle Präsenz am Acyltransferreaktiounssystem sinn.
➢ AMD soll lescht an Reaktioun System mat optimal Reaktioun pH an Temperatur dobäi ginn.
➢ All Zorte vun AMD hu verschidden optimal Reaktioun Konditiounen, also jiddereng vun hinnen soll weider individuell studéiert ginn.
Beispill 1(1):
Hydrolyse Aktivitéit op verschidden Amide Substrate
| Substrat | Spezifesch Aktivitéit μmol min-1mg-1 | Substrat | Spezifesch Aktivitéit μmol min-1mg-1 |
| Acetamid | 3.8 | ο-OH Benzamid | 1.4 |
| Propionamid | 3.9 | p-OH Benzamid | 1.2 |
| Laktamid | 12.8 | ο-NH2benzamid | 1.0 |
| Butyramid | 11.9 | p-NH2benzamid | 0.8 |
| Isobutyramid | 26.2 | ο- Toluamid | 0.3 |
| Pentanamid | 22.0 | p- Toluamid | 8.1 |
| Hexanamid | 6.4 | Nikotinamid | 1.7 |
| Cyclohexanamid | 19.5 | Isonicotinamid | 1.8 |
| Acrylamid | 10.2 | Picolinamid | 2.1 |
| Metacrylamid | 3.5 | 3-Phenylpropionamid | 7.6 |
| Prolinamid | 3.4 | Indol-3-Acetamid | 1.9 |
| Benzamid | 6.8 |
D'Reaktioun gouf an 50mM Natriumphosphatbufferléisung, pH 7,5, bei 70 ℃ duerchgefouert.
| Amiden | Hydroxylamin | Hydrazin |
| Acetamid | 8.4 | 1.4 |
| Propionamid | 18.4 | 3.0 |
| Isobutyramid | 25,0 | 22.7 |
| Benzamid | 9.2 | 6.1 |
D'Reaktioun gouf an 50mM Natriumphosphatbufferléisung, pH 7,5, bei 70 ℃ duerchgefouert.
Zesummenhang reagent Konzentratioun: amides, 100 mM (benzamide, 10 mM);Hydroxylamin an Hydrazin, 400 mM;Enzym 0,9 μM.
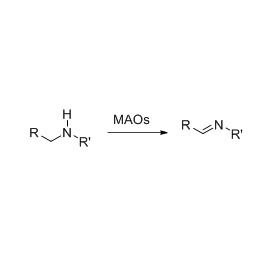
Beispill 2(2):
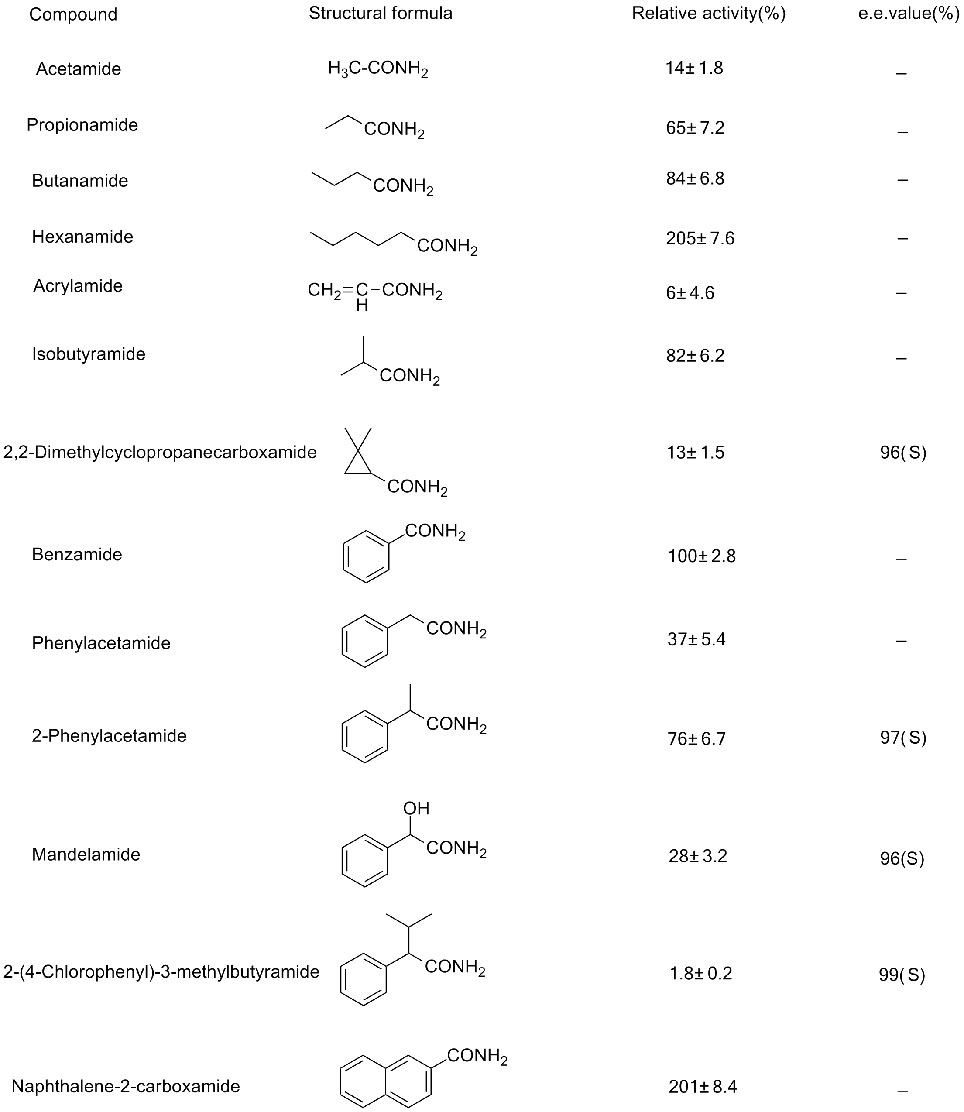
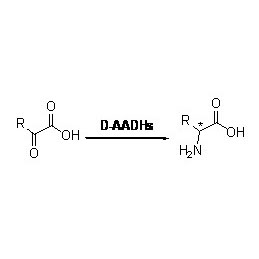
Beispill 3(3):
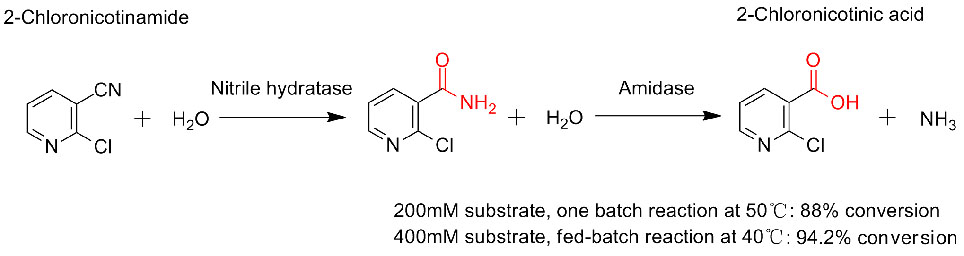
1. D'Abusco AS, Ammendola S., et al.Extremophiles, 2001, 5:183-192.
2. Guo FM, Wu JP, Yang LR, et al.Prozess Biochemie, 2015, 50 (8): 1400-1404.
3. Zheng RC, Jin JQ, Wu ZM, et al.Bioorganic Chemistry, 2017, Online verfügbar 7.